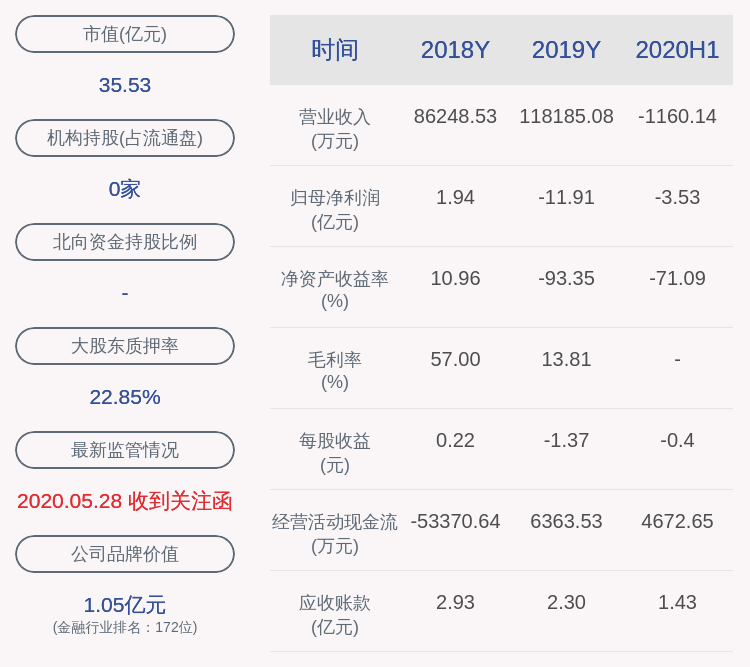
【探针|徐平勇课题组在pH敏感探针上取得重要进展】近日 , 中国科学院生物物理研究所徐平勇研究员课题组在《Nature Communications》上发表了题为"pHmScarlet is a pH-sensitive red fluorescent protein to monitor exocytosis docking and fusion steps" 的研究文章 。
自20世纪60年代至今 , 囊泡分泌和运输相关研究领域已经斩获4次诺贝尔生理或医学奖 , 平均每隔十几年就获奖一次 , 是生命科学研究的前沿领域 。 虽然国内外科研人员对囊泡分泌及运输的动态过程进行了广泛研究 , 但其详细的分子调控机制还存在诸多未解之谜 。 主要原因是囊泡分泌及运输的过程十分复杂 , 严格调控了细胞与外界环境的物质交换和信息交流 。 尤其是存在于神经元、内/外分泌细胞等可兴奋型细胞以及免疫细胞等特化细胞中的调节型胞吐 , 涉及多个步骤、多个蛋白质分子以及相关耦联事件在时间和空间上的精确调控 。 对神经递质和生物酶的释放、激素分泌、天然免疫等重要生理活动的维持和调控起着至关重要的作用 , 因而备受国内外研究人员关注 。
囊泡胞吐作用是一个快速的动态过程 , 通过控制囊泡包裹的活性肽或神经递质向细胞外部释放 , 从而调节重要的生理功能 。 目前对囊泡胞吐的检测技术主要包括电生理和光学成像的方法 。 基于膜片钳的电生理检测技术可以对单个细胞的胞吐事件进行检测 。 该技术的主要优势是操作的时间分辨率高 , 可以在毫秒尺度上检测单个细胞中囊泡的胞吐事件 。 然而电生理检测技术主要用于离体单个细胞或者脑片中单个细胞的检测 , 很难实现多个细胞的同时检测以及在体监测 。 另外膜片钳技术检测的是单个细胞中多个囊泡胞吐的表观事件 , 无法对单个囊泡的锚定和融合过程进行观察和检测 。 与之相对应 , 基于光学成像的检测技术可以同时对多个细胞中的囊泡胞吐事件进行追踪和记录 。 重要的是该技术还可以对单个囊泡的胞吐事件进行检测 , 这对于在分子水平揭示囊泡与质膜锚定、融合的调控机理非常重要 。 在这些过程中 , 荧光蛋白融合标记为显微成像提供了强有力的工具 。 与可透膜的荧光染料相比 , 荧光蛋白不仅成像背景低、信噪比高 , 而且其生物毒性低、表达量可控 , 是活细胞成像的首选 。
成熟的囊泡腔内为酸性pH 环境(pH 约为5.6) 。 胞吐时 , 囊泡膜与质膜发生融合 , 腔内pH 瞬间切换为偏碱性的细胞外环境(pH 约为7.4) 。 基于此特性 , Miesenbock G. 等人通过氨基酸突变及筛选 , 最终获得pH 敏感型GFP 突变体 , pHluorin 。 由于pHluorin在pH 5.5 时几乎完全淬灭 , 而在pH 7.5 时绿色荧光强度提高约50 倍 , 因此已被广泛用于检测突触囊泡、分泌小泡和再循环内体的胞吐作用 。 然而 , 由于发生膜融合前 , 位于质膜附近囊泡内的pHluorin 荧光信号很弱 , 限制了其追踪囊泡锚定步骤的应用 。 另一方面 , 现有的红色pH 敏感荧光蛋白探针与pHluorin相比 , pH敏感性相差甚远 。 其中pHuji的性质相对较好 , 但该蛋白荧光强度低 , 而且具有快速的荧光衰减特性 , 其荧光强度在
本研究中 , 团队成员开发了一个亮度高、稳定性好、pH 敏感性强的红色荧光蛋白探针pHmScarlet 。 该探针在现有红色荧光蛋白中具有最高的pH敏感性 , 能检测到更多的分泌事件 , 且能同时可视化分泌事件中的囊泡锚定和融合步骤 。 在用于囊泡分泌事件检测时 , pHmScarlet具有与绿色pH敏感荧光蛋白pHluorin媲美的分泌信号 。 此外 , pHmScarlet还具有pHluorin不具备的检测能力 。 pHmScarlet的pKa值使得其在酸性条件下可检测完整囊泡中的荧光强度 , 实现对囊泡锚定步骤的追踪和记录 。 同时该探针可以与pHluorin 结合 , 对多个囊泡蛋白进行双色成像(图1 a-c) 。 另一方面 , 尽管pHmScarlet的发射波长与pHluorin相比明显红移 , 但其空间分辨率足够高 , 可以使用Hessian结构光照明显微镜(Hessian-SIM)进行超高分辨率成像 , 解析出囊泡融合孔的环形结构(图1 d-f) 。 可以预测 , 该pH敏感红色荧光蛋白探针将在囊泡分泌与运输领域有更广泛的应用 。
文章插图
图1 (a-c)pHmScarlet与pHluorin对不同囊泡膜蛋白进行双色成像;(d-f)囊泡分泌事件的超高分辨显微成像
该工作由中国科学院生物物理研究所、北京大学、中科院遗传发育所等单位合作完成 。 中国科学院生物物理研究所袁琳副研究员和徐平勇研究员为该文章的共同通讯作者 。 中国科学院生物物理研究所与中国科学技术大学联合培养博士研究生刘安远以及北京大学跨学部生物医学工程系副研究员黄小帅为该文章共同第一作者 。 中科院遗传所刘佳佳课题组、北京大学陈良怡课题组、中科院生物物理所王磊研究员等对该工作给予了大力帮助
该工作受到国家重点研发计划、国家自然科学基金、中科院先导专项、以及中科院科研仪器设备研制等项目的资助 。 感谢王磊研究员的帮助与支持 。
推荐阅读
- 遗传|厦大课题组解析DNA:汉藏同源、台湾地区古人与壮侗同源
- 抗体|《自然》:清华祁海教授课题组报道高亲和力抗体筛选的新机制
- 贵州大学|贵州大学葛翔课题组在锂电容体积能量密度研究取得重要进展
- |华东理工大学解永树教授课题组近年来卟啉研究进展
- 科学家揭示荧光团缺电子性在近红外荧光探针识别机制中的作用
- 上皮组织|白凡/徐涛课题组合作揭示癌旁正常上皮组织存在大量突变及克隆扩增
- 乙酰胆碱|脑科学日报:新一代乙酰胆碱探针实现体内乙酰胆碱信号的精确解析
- 央行反洗钱局课题组:如何改进反洗钱调查工作?
- 黄河|河南日报文化繁荣课题组 | 黄河落天 文鼎中原
- 孙育杰|孙育杰课题组与合作者揭示线粒体DNA分配新机制