门静脉|腹痛,十二指肠溃疡,门静脉高压:非一般性“胰腺占位”
作者:陆 佳1 , 郭 涛1 , 李 骥1 , 杨爱明1 , 张太平2 , 薛华丹3 , 曹 玮4 , 冯瑞娥5单位:北京协和医院 1消化内科 2基本外科 3放射科 4感染内科 5病理科
1 病历简介
患者男性 , 28岁 , 因“间断上腹痛8个月 , 加重伴低热、盗汗1个月 , 黑便3d”于2019年4月26日收住北京协和医院消化内科 。1.1 现病史
患者2018年10月饥饿后出现右上腹持续性绞痛 , 疼痛数字评分 5分 , 无放射 , 进食后30 min可缓解 , 无发热、呕吐及黑便 。
2019年1月于外院就诊 , 查血常规正常;血生化示总胆红素(total bilirubin, TBil)4.7 μmol/L , 谷丙转氨酶(alainine aminotransferase, ALT)52 U/L , 谷草转氨酶(aspartate aminotransferase, AST)43 U/L;
红细胞沉降率(erythrocyte sedimentation rate, ESR)58 mm/h , 超敏C-反应蛋白(hypersensitive C-reactive protein, hs-CRP)31.17 mg/L;
血混合淋巴细胞培养+干扰素(N)0.08 IU/mL , 混合淋巴细胞培养+干扰素(T)0.76 IU/mL , 混合淋巴细胞培养+干扰素(M)>10.00 IU/ mL;结核杆菌γ-干扰素(T-N):0.68 IU/mL , 结核杆菌γ-干扰素(M-N)>10.00 IU/mL;腹部增强CT示胰头区占位;超声内镜示胰颈后方低回声肿物伴液化及钙化 , 脾静脉增宽;
电子胃镜示十二指肠球降交界部巨大溃疡 , 病理提示:邻溃疡坏死层肉芽肿性炎改变 , 较多上皮样细胞 , 抗酸染色阴性 。
予患者艾司奥美拉唑抑酸、左氧氟沙星抗感染治疗1周后复查胃镜较前无改善 , 溃疡病理示可疑干酪样坏死 , 抗酸染色可疑阳性 , 结核杆菌基因检测阳性 。
考虑结核可能性大 , 于1月19日开始予异烟肼0.3 g/d+利福平0.45 g/d+乙胺丁醇0.75 g/d+吡嗪酰胺0.75 g/d四联抗结核治疗 。 用药2周后因血小板(platelet , PLT)减少至85×109/L , 调整治疗方案为乙胺丁醇0.75 g/d+异烟肼0.3 g/d+吡嗪酰胺1.5 g/d , 期间患者尿酸升高至622μmol/L , 予非布司他和碳酸氢钠治疗 。
4月初复查血常规正常;血生化示TBil 77.6μmol/L , 直接胆红素(direct bilirubin, DBil)45.3μmol/L , ALT 151 U/L , AST 100 U/L , 碱性磷酸酶(alkaline phosphatase, ALP)472 U/L , 谷氨酰转肽酶(gamma glutamyl transpeptidase, GGT) 816 U/L;ESR 18 mm/h , hs-CRP 10.05 mg/L;肝、胆、胰、脾彩色多普勒超声检查示胰头上方混合肿块 , 受累门静脉主干中段管腔中重度狭窄 , 肝内、外胆管轻度扩张 , 脾肿大 。
考虑患者存在肝功能异常 , 暂停抗结核治疗 , 加用保肝药物 。 4月9日患者腹痛症状加重 , 为持续性胀痛 , 以剑突下为著 , 向腰背部放射 , 伴低热、乏力、盗汗 , 最高体温 38.3℃ , 可自行下降 , 无畏寒、寒战 。
于我院门诊查血常规示白细胞(white blood cell, WBC)16.66×109/L , 中性粒细胞比例(neutrophil count, NEUT%)90.1% , 血红蛋白(hemoglobin , Hb)108 g/L ,PLT 243×109/L;血生化示TBil 38.3μmol/L , DBil 27.9μmol/L , ALT 110 U/L , AST 46 U/L , ALP 372 U/L , GGT 426 U/L;ESR 86 mm/h;
淋巴细胞培养+干扰素A+B:0+32FC/10S6MC;糖链抗原199 98.5 U/ mL;
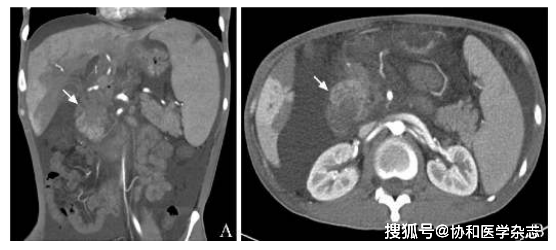
腹部CT平扫+胰腺CT薄层扫描示胰头增大 , 密度不均匀 , 周围多发增大淋巴结 , 肝内外胆管扩张 , 脾大 , 腹膜后似见肿大淋巴结(图1) 。
4月22日患者出现柏油样黑便 , 2次/d , 量约50 mL /次 , 同时伴腹痛、乏力 , 无呕血 。 起病以来 , 患者食欲、精神差 , 小便色黄 , 体重下降5 kg 。
文章图片
图1 腹部CT平扫+胰腺CT薄层扫描示胰头增大 , 密度不均匀(箭头 , 2019年4月9日)A.冠状面;B.横断面
1.2 既往史及其他病史
起病前工作劳累、生活作息不规律;否认结核病史和结核接触史;吸烟5年 , 现5支/d;幼年曾饮用未规范消毒牛奶;家族史、婚育史无特殊 。
1.3 入院查体
生命体征平稳 , 体质量指数 15 kg/m2 , 贫血貌 , 全身浅表淋巴结未触及肿大;双肺呼吸音清 , 心律齐 , 未闻及心脏杂音;腹韧、稍膨隆 , 腹壁无静脉曲张 , 右上腹及剑突下压痛阳性 , 无反跳痛及肌紧张 , 肝脾肋下未触及 , 墨菲氏征阴性 , 肝区无叩击痛 , 移动性浊音阳性 , 肠鸣音6次/min;双下肢轻度可凹性水肿 。
1.4 实验室检查
血常规:WBC 18.98×109/L , NEUT% 90.0% , Hb 43 g/L , PLT 200×109/L;网织红细胞百分比5.4% 。 正细胞正色素性贫血 。
便常规:WBC及红细胞阴性 , 潜血阴性 。
血生化:白蛋白22 g/L , TBil 10.4μmol/L , ALT 16 U/L , 尿素氮2.74 mmol/L , 血肌酐46μmol/L , 淀粉酶 34 U/L , 脂肪酶 14 U/L 。
免疫球蛋白三项:免疫球蛋白G 1670 mg/dl , 免疫球蛋白M 71.8 mg/dl , 免疫球蛋白A 191 mg/dl 。
铁四项检查:血清铁13μg/dl , 血清铁总铁结合力78μg/dl , 铁饱和度12.5% , 转铁蛋白饱和度16.7% , 血清铁蛋白342 ng/ mL 。
凝血功能:凝血酶原时间16.2 s , 国际标准化比值1.39 , 纤维蛋白原 6.28 g/L , D-二聚体 4.57 mg/L FEU , 活化部分凝血活酶时间 31.5 s 。
感染四项:乙型肝炎表面抗原阴性 , 丙型肝炎抗体阴性 , 梅毒螺旋体抗体阴性 , 艾滋病病毒抗体初筛阴性 。
炎症指标:ESR 121 mm/h , hs-CRP 96.83 mg/L 。
肿瘤标志物:糖链抗原199 4.6 U/mL , 癌胚抗原正常 。
1.5 腹水检查
腹水常规:外观淡黄色微混 , 比重1.013 , 细胞总数529×106/L , WBC总数321×106/L , 单核细胞百分比38.0% , 多核细胞百分比62.0% 。 黎氏试验阴性 。
腹水生化:乳糜试验阳性 , 总蛋白14 g/L , 腺苷脱氨酶0.7 U/L , 白蛋白6 g/L , 乳酸脱氢酶30 U/L , 葡萄糖5.6 mmol/L , 氯110 mmol/L , 淀粉酶60 U/L , 脂肪酶363 U/L 。
腹水病原学检查:腹水淋巴细胞培养+干扰素A: 232 SFCs/10^6 PBMC , B: 592 SFCs/10^6 PBMC;结核/非结核分枝杆菌核酸测定、细菌涂片和培养、真菌涂片和培养、抗酸染色、 奴卡氏菌涂片及放线菌培养均阴性 。
腹水肿瘤指标:癌胚抗原小于0.200 ng/mL , 糖链抗原199小于0.600 U/mL;液基细胞学病理诊断:未见瘤细胞 。
1.6 影像学检查
门静脉彩色多普勒超声:门静脉海绵样变 , 门静脉主干及分支栓塞可能性大 , 胰头区脾静脉及肠系膜上静脉受占位包裹管腔变细 。
胸部CT平扫:右肺下叶背段磨玻璃影 , 双肺多发索条影 , 双侧胸腔积液 。
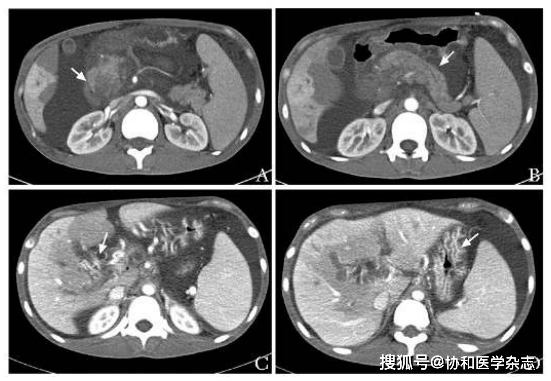
腹盆增强CT+胰腺CT薄层扫描:腹腔新见大量积液;肝实质内片状门静脉期强化减低影;肝S6 段结节斑片样强化减低灶 , 占位性病变不除外;与4月9日CT相比 , 胰头增大 , 密度强化不均匀 , 较前加重;胰管轻度扩张;新片示门静脉主干及肝内分支充盈不清 , 门静脉海绵样改变 , 食管胃底及门静脉其它属支多发静脉曲张(图2);新见肝门区片状低密度低灌注;肝内外胆管略扩张 , 增强后胆总管下段被异常强化血管团包裹、狭窄;脾大;腹膜后似见肿大淋巴结 。
文章图片
图2 腹盆增强CT+胰腺CT薄层扫描图像(2019年4月29日)A.胰头增大 , 密度强化不均匀 , 较前加重(箭头);B.胰
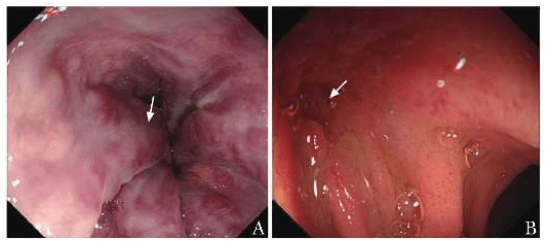
电子胃镜检查:食管静脉曲张(中-重度) , 十二指肠球后黏膜局部深凹陷 。 胃镜采集病理结果提示十二指肠球后黏膜显急性及慢性炎 , 局部绒毛钝缩 , 固有层水肿;特殊染色结果示抗酸染色结核杆菌(-) , 弱抗酸染色(-) 。 (图3)
文章图片
图3 电子胃镜示中-重度食管静脉曲张呈现红色征(A , 箭头) , 十二指肠球后黏膜凹陷 , 局部黏膜充血水肿明显(B , 箭头)
2 多学科讨论
2.1 消化内科青年男性 , 隐匿起病 , 慢性病程;临床以腹痛起病 , 逐渐出现低热、乏力、盗汗和黑便症状;实验室检查示重度贫血 , 影像学检查示胰头区占位 , 十二指肠溃疡和门静脉高压 。
2.1.1 胰头占位性质
患者胰腺CT示胰头区占位 , 密度不均匀 , 超声内镜示胰颈后方低回声肿物伴液化及钙化 , 性质鉴别如下:
①胰腺恶性肿瘤:患者腹痛症状突出 , 病情进展迅速 , 消耗症状明显 , 糖链抗原199升高 , 胰头区低回声占位性病变 , 侵犯十二指肠可能 , 包绕胰头区脾静脉及肠系膜上静脉致管腔变细 , 门静脉主干及分支受累 , 腹腔多发淋巴结肿大 , 需警惕胰腺恶性肿瘤可能;但患者较年轻 , 非胰腺恶性肿瘤好发年龄 , 且十二指肠溃疡性病变病理示结核感染 , 无肿瘤提示 , 抗结核治疗后胃镜下病变较前明显改善 , 故不符合肿瘤表现 。
②胰腺结核:患者青年男性 , 低热、乏力、盗汗等结核中毒血症症状明显 , 既往有摄入未经巴氏消毒的牛奶史 , 血结核杆菌γ-干扰素检测阳性 , 结核菌素试验阳性 , ESR升高 , 外院胃镜取十二指肠溃疡病理可见可疑干酪样坏死 , 抗酸染色可疑阳性 , 结核杆菌基因检测阳性 , 考虑十二指肠溃疡为结核感染所致;胰腺结核或肿瘤在超声内镜下均可为低回声病变 , 但存在钙化更提示为结核;结合十二指肠病变 , 从一元论角度考虑 , 胰头区占位为结核可能性大 。
目前超声内镜引导下细针穿刺抽吸术(endoscopic ultrasound-guided fine-needle aspiration , EUS-FNA)在明确胰腺占位病变性质上愈受重视 , 其安全性良好 , 可反复针吸多条组织块送检 , 提高病理诊断准确率 , 从而避免手术 , 但本例患者病变部位较多迂曲扩张血管 , 穿刺出血风险较高 , 故暂不考虑行超声内镜引导下穿刺活检 。
2.2.2 腹水性质
患者大量腹腔积液 , 外观淡黄色微混 , 血清腹水白蛋白梯度>11 g/L , 腹水比重<1.018 , 黎氏试验阴性 , 腹部CT示门静脉海绵样变 , 其属支多发静脉曲张 , 脾大 , 胃镜下可见中-重度食管静脉曲张 , 考虑胰腺病变累及门静脉主干及其分支导致门脉高压 , 进而产生门脉高压性腹水;同时患者腹水WBC明显升高 , 淋巴细胞培养+干扰素(A+B)数值显著高于血清 , 提示亦存在结核性腹水 。 综上 , 考虑患者腹水为混合性质 , 包括门脉高压性腹水和结核性腹水 。
2.1.3 消化道出血原因
患者病程中出现黑便 ,2019年1月外院胃镜可见十二指肠溃疡 , 故需考虑十二指肠溃疡所致消化道出血;但患者黑便为近期新发 , 而抗结核治疗3个月后内镜下十二指肠溃疡较前明显好转 , 似乎无法用十二指肠溃疡解释 。 我院4月复查胃镜新见中-重度食管静脉曲张 , 局部黏膜可见红色征 , 考虑患者消化道出血原因为食管静脉曲张破裂出血可能性大 , 可予普萘洛尔10 mg ×2次/d扩张血管、降低门静脉压力 , 必要时予内镜下治疗 。 患者消化道出血、食管静脉曲张及腹水出现在病程上存在时间的一致性 , 考虑与胰腺病变所致门静脉主干狭窄闭塞引起的门脉高压进行性加重相关 。 患者影像学检查提示门静脉主干栓塞可能 , 但近期出现消化道出血 , 抗凝风险较大 , 暂不抗凝 。
2.1.4 黄疸原因
患者胆红素升高以DBil为主 , 伴胆管酶升高 , 结合影像学胰头区占位伴肝内外胆管扩张 , 需考虑胰腺病变所致梗阻性黄疸 。 但患者黄疸的出现是在服用抗结核药物治疗后 , 且停用所有抗结核药物后胆红素水平自行恢复正常 , 与胰头区占位病变大小并无显著改善及肝内外胆管持续扩张表现并不相平行 , 因此考虑患者黄疸病因为抗结核药物所致的药物性肝损害 , 临床表现为肝内胆汁淤积 , 易与梗阻性黄疸相混淆 。
2.2 放射科
根据患者腹部盆腔增强CT影像分析 , 新片与老片对比 , 表现为胰头区增大、边界不清、密度强化不均匀 , 需考虑胰头占位性病变 , 如胰腺炎性病变(胰腺结核或自身免疫性胰腺炎)、胰腺恶性肿瘤等 。
自身免疫性胰腺炎的影像学特点为CT上多同时有胰头体尾弥漫性肿大 , 呈“腊肠样”外观;而局灶型自身免疫性胰腺炎可仅有胰头肿大 , 但一般不侵犯十二指肠 , 与患者影像学特点不符 。
对于胰腺恶性肿瘤和胰腺结核 , CT有时难以鉴别 , 因两者均可表现为低密度占位性病变 , 累及周围组织、淋巴结和血管 。 血管受累包括血管狭窄和血栓形成 , 多见于肿瘤性病变 , 然而亦有文献报道胰腺结核可累及门静脉及其分支 , 且并不少见 。 考虑钙化是结核的常见CT征象 , 本例患者腹部增强CT可见胰头区占位体积较大、边界不清 , 内部散在点状钙化 , 不除外淋巴结结核融合包绕胰头形成占位性病变 。 相对于胰腺结核 , 胰腺恶性肿瘤更容易出现胰管扩张 , 而该患者的影像学并未提示明显胰管扩张 。
此外 , 患者新见门静脉主干充盈不清、可疑栓塞 , 门静脉海绵样改变 , 食道胃底及门静脉其它属支多发静脉曲张、脾大和腹腔积液 , 考虑胰头区占位累及门静脉 , 继发门脉高压 。 患者肝门区片状低密度低灌注 , 增强后胆总管下段被异常强化血管团包裹导致狭窄 , 可以解释肝内外胆管略扩张 。 结合以上影像学表现 , 考虑患者胰头区占位性病变性质倾向于胰腺结核或胰周淋巴结结核 , 胰腺恶性肿瘤不能除外 。
2.3 病理科
患者于2019年1月携外院十二指肠球后溃疡病理于我院疑难病理会诊 , 结果示小肠黏膜显慢性炎 , 其内见类上皮细胞肉芽肿结节伴凝固性坏死 , 此种病理表现多见于分枝杆菌感染 。
非结核分枝杆菌感染病理表现与结核病较难鉴别 , 也可出现类上皮细胞、朗汉斯巨细胞肉芽肿形成为主的增殖性反应 , 但非结核分枝杆菌病的机体组织反应较弱 , 坏死较少 。
胰腺结核或十二指肠结核患者往往不易在组织中找到或培养出结核杆菌 , 典型的胰腺结核病理可见干酪样坏死、类上皮细胞、朗格汉斯巨细胞肉芽肿、抗酸染色阳性 , 其中肉芽肿多见但不具有特异性 , 干酪样坏死和抗酸染色阳性最具诊断意义 。
此次病理特殊染色未找到病原菌 , 抗酸染色和弱抗酸染色均阴性 , 无明确结核感染病原学证据 , 但根据既往临床经验 , 即使是明确的结核病 , 包括胰腺结核或十二指肠结核 , 活检取得的病理也少见干酪样坏死 , 而抗酸杆菌多见于干酪样坏死灶 , 在肉芽性组织中一般难以找到 , 且病理切片的抗酸杆菌在退行性改变时染色可减弱或完全不着色 , 因此易导致假阴性的可能 。
近年来随着分子诊断技术的发展 , 结核杆菌基因检测阳性在结核病的诊断中愈加重要 , 该患者外院结核杆菌基因检测阳性 , 具有较强提示意义 。 2019年4月 , 患者于我院复查十二指肠球后黏膜病理 , 此时抗结核治疗已3个月 , 与前期会诊病理比较 , 未见明确上皮样肉芽肿病变或坏死 , 局部炎症背景较前减轻 , 考虑治疗有效 。 结合患者临床表现及我院病理结果 , 考虑患者十二指肠溃疡性病变为结核感染可能性大 。
2.4 感染内科
患者为青年男性 , 慢性病程 , 临床上结核中毒血症症状突出 , 既往饮生牛奶病史 , 结核菌素试验阳性 , 腹水及血淋巴细胞培养+干扰素水平升高 , 以腹水升高为主 , 十二指肠溃疡病理见上皮样细胞肉芽肿结节伴凝固性坏死 , 符合结核感染表现 , 考虑患者十二指肠或腹膜后存在活动性结核感染 。 患者感染四项均阴性 , 免疫球蛋白三项水平正常 , 未发现明确的免疫缺陷 , 发病前劳累、作息不规律 , 可能为诱发因素 。 因此治疗上除抗结核外 , 需避免劳累 , 作息规律 。 治疗方面 , 腹腔结核的治疗方法与肺结核相同 , 标准治疗为包括含一线抗结核药物异烟肼5(4~6)mg/(kg·d)+利福平10(8~12)mg/(kg·d)+乙胺丁醇15(15~20)mg/(kg·d)+吡嗪酰胺25(20~30)mg/(kg·d)四联强化治疗2个月 , 序贯异烟肼和利福平的维持治疗至少4个月 。 部分患者会出现抗结核药物不良反应 , 主要包括胃肠道反应、肝损害、过敏反应、高尿酸血症、耳毒性和肾毒性等 , 以肝损害最为常见 , 大部分不良反应仅需对症处理 。
本例患者在应用四联治疗过程中出现肝功能异常、PLT减少和高尿酸血症 。 异烟肼、利福平、吡嗪酰胺均可引起肝损害 , 患者停用利福平后肝功能恢复正常 , 考虑为利福平引起;高尿酸血症考虑为吡嗪酰胺引起 , 机制为吡嗪酰胺的代谢产物吡嗪酸抑制体内尿酸排出 , 可导致四肢关节和肌肉疼痛 , 尿酸升高后予非布司他和碳酸氢钠对症治疗效果不佳 , 可停用吡嗪酰胺;利福平和异烟肼均可能引起PLT减少 , 联合用药可加重骨髓抑制 , 本例患者外院PLT减少至85×109/L , 停用利福平后PLT恢复正常 , 考虑其骨髓抑制主要为利福平引起 。 根据《耐药结核病化学治疗指南(2019年)》推荐 , 患者的抗结核药物可选择:续用异烟肼和乙胺丁醇 , 加用一种注射类抗结核药物 , 由于链霉素耐药率高 , 基于不良反应和药物的可获得性 , 可给予阿米卡星15~20 mg/(kg·d) , 可深部肌内注射或静脉滴注;同时加用一种高代的氟喹诺酮类药物 , 如左氧氟沙星10~15 mg/(kg·d) , 可口服或静脉滴注 。 需密切观察血常规、肝肾功能及听力变化 , 警惕药物副作用 。
2.5 基本外科
结合患者病史及辅助检查 , 目前考虑胰头区占位 , 结核感染可能性大 , 不除外淋巴结融合 。 胰腺结核与胰周淋巴结结核临床表现无特异性 , 均可有低热、盗汗、乏力、体重减轻等全身消耗症状以及腹胀、腹痛、腹泻等消化道症状 。 由于胰腺分泌的胰液具有较强的杀菌力 , 故临床中原发性胰腺结核较罕见 , 而胰头周围淋巴结及淋巴管丰富 , 为淋巴结结核的好发部位 , 淋巴结结核直接扩散可导致胰头区域感染 , 因此胰周淋巴结结核相对多见 , 且多与胰腺结核伴行 。 胰腺结核CT特点可表现为弥漫肿大型、多发结节型和局灶型 , 可发生于胰腺任何部位 , 肿块内可见点状钙化;胰周淋巴结结核在CT上表现为胰周淋巴结肿大 , 以头颈、体部为主 , 可出现钙化 , 增强扫描呈环形强化 , 淋巴结部分融合后呈“花环状”改变 , 结合患者影像学检查特点考虑胰周淋巴结结核伴发胰腺结核可能性大 。 胰腺癌罕见钙化 , 增强后一般为不均匀强化 , 多伴有显著胰管扩张及肝内外胆管扩张 。 患者目前诊断倾向结核感染 , 无明确手术指征 , 可先继续予抗结核保守治疗 , 密切监测患者胰腺及胰周病变情况 , 根据抗结核治疗效果决定进一步处理 。
3 讨论后处理
4月27日起予患者异烟肼0.3g/d+乙胺丁醇0.75g/d+左氧氟沙星0.5g/d+阿米卡星0.4g/d抗结核治疗;同时予普萘洛尔10 mg×2次/d 降低门静脉压力 , 洛赛克抑酸、呋塞米利尿 , 并补充铁剂及静脉营养等对症支持治疗 。 患者体温正常 , 腹痛明显改善 , 偶有餐后腹胀 , 无盗汗、乏力 , 大小便正常 , 体重逐渐增加5 kg 。 至5月20日出院前复查血常规示WBC 3.81×109/L , NEUT% 66.6% , Hb 82 g/L , PLT 84×109/L;血生化示白蛋白39 g/L , Tbil 8.1μmol/L , ALT 36 U/L;炎症指标示ESR 35 mm/h , hs-CRP 2.54 mg/L 。4 最终诊断
胰腺、胰周淋巴结结核可能性大 , 十二指肠和门静脉受累 , 并发门静脉高压 。5 治疗及随访
患者出院后规律应用 , 异烟肼0.3 g/d+乙胺丁醇0.75g/d+左氧氟沙星0.5g/d+阿米卡星0.4g/d抗结核治疗 , 无发热、腹痛、腹胀等症状 , 体重较出院时无明显变化 。 2019年8月7日(抗结核总疗程近6个月)返院复查血常规:WBC 3.31×109/L , NEUT% 52.3% , Hb 133 g/L , PLT 61×109/L;肝肾功能正常;炎症指标示ESR 6 mm/h , hs-CRP 0.22 mg/L;腹部盆腔增强CT+胰腺CT薄层扫描示腹腔积液消失;原肝实质内大片状门脉期减低影和肝S6段结节斑片样强化减低灶 , 此次不明显;胰头增大、密度强化不均匀 , 较前变化不大;门静脉海绵样变 , 伴多发侧枝循环较前稍明显;肝内外胆管略扩张 , 较前减轻 。6 讨论
本例为青年男性 , 慢性病程 , 临床上腹痛、发热、盗汗、体重下降突出;实验室和影像学检查示胰头区占位性病变 , 结核可能性大 , 侵犯十二指肠可能 , 胰腺病变累及门静脉导致门静脉高压 , 继发腹水、脾大、食管胃底静脉曲张 , 进而出现消化道出血;患者抗结核治疗总疗程近6个月后 , 临床症状缓解 , 腹水消失 , 炎症指标正常 , 胰头病变未再进展 。本例患者在诊治过程中对于胰腺结核的相关鉴别诊断存在一定难度 。 腹腔结核包括累及胃肠道、腹膜、淋巴结和/或实体器官的结核 , 约占所有结核病例的5%[1] 。 其中腹膜结核、肠结核和肝结核较为常见 , 十二指肠结核和胰腺结核较为罕见 , 且多继发于肺结核[2-3] 。 胰腺结核的临床症状和影像学表现常常难以与胰腺肿瘤进行鉴别[4] , 因此既往胰腺结核诊断多来源于考虑胰腺恶性肿瘤患者的手术标本[5] , 近年来随着影像学技术的发展和获取胰腺组织方法的增多 , 胰腺结核诊断率明显增加[3,6] , 但目前尚无多中心临床流行病学研究调查胰腺结核的发病率和患病率 。
进一步分析 , 胰腺结核的可能病因有[7]:
(1)原发胰腺结核 , 少见;
(2)淋巴管及血行播散 , 多为隐匿的肺内结核的血源播散或从腹膜后淋巴结播散 , 可有腹腔和胰周淋巴结结核 , 病变好发于胰头及钩突部 , 可能与该处血运及淋巴管丰富有关;
(3)全身播散性结核 , 同时并发开放性肺结核和腹腔结核 , 胃肠道受累较多 。
【门静脉|腹痛,十二指肠溃疡,门静脉高压:非一般性“胰腺占位”】本例患者既往并无肺结核病史和接触史 , 胸部CT未见明确肺结核征象 , 影像学及内镜检查提示病变累及胰头、胰周淋巴结 , 与十二指肠分界不清 , 且十二指肠溃疡病理证实为结核 , 因此胰腺结核考虑为胰周淋巴结结核播散可能性大 , 侵犯十二指肠及门静脉系统 。
病例系列研究显示胰腺结核多见于青中年男性 , 其临床表现无特异性[8] , 可出现低热、乏力、盗汗、食欲下降、体重减轻等结核全身中毒血症症状 , 以及腹胀、腹痛、黄疸等消化系统症状 , 部分患者可触及腹部包块和浅表肿大淋巴结[9] 。
目前有多种影像学检查方法可用来评估胰腺结核:
(1)彩色多普勒超声 。 其操作简单且无辐射 , 可发现胰周淋巴结增大、腹水、肝内外胆管扩张以及血管病变[9]。 绝大多数胰腺结核显示为等回声或低回声病变 , 但由于容易受肠气干扰 , 常导致超声影像显示不清 , 可能会遗漏较小的病变 。
(2)腹部增强CT 。 腹部增强CT可更加准确地评估病变范围 , 有无胰腺钙化、肝胆病变和血管受累 。 胰腺结核在CT上多为低密度占位性病变 , 可有边缘强化[6] , 病变多位于胰头 , 可累及周围淋巴结和血管 , 表现上可模拟胰腺恶性肿瘤、胰腺囊性病变和肿块型胰腺炎等 , 往往与之难以鉴别 。 在一项9例胰腺结核患者的队列研究报道中 , 5例患者CT显示胰头部肿块 , 1例胰尾肿块 , 2例胰腺囊性病变 , 2例患者存在胰腺钙化或脾静脉血栓[10] 。 部分病例报告了血管受累 , 包括门静脉、肠系膜上静脉、肝动脉等[6,11] 。
(3)超声内镜 。 可通过细针穿刺获取病变组织进行病理和病原学检查 , 对于较小的病变具有明显优势 [12], 其临床价值较高 , 可较准确评估胰胆系病变大小和累及范围 , 是否存在淋巴结肿大、胰胆管扩张、钙化和血管侵犯 。 超声内镜下胰腺结核为低回声病变 , 同胰腺腺癌鉴别困难 , 但由于肿瘤患者多年龄较大 , 胆红素水平更高 , 胆总管扩张更明显 , 胰管扩张比例更高[11] , 也可综合以上临床特点相鉴别 。
(4)磁共振成像 。 临床多用于评估因占位压迫导致的胰管和胆管病变 , 胰腺结核在T1加权像可能为低信号、在T2加权像为高信号[13] 。
(5)正电子发射断层显像/计算机体层成像(positron emission tomography/computed tomography, PET/CT) 。 因其无法完全可靠地区别胰腺结核和胰腺癌 , 胰腺结核也可表现为高摄取[14], 故临床较少用于评估胰腺结核 。
(6)内镜逆行胰胆管造影 。 可观察局部胰胆管腔内病变 , 置入支架缓解梗阻 。
组织学诊断是胰腺结核诊断的金标准 。 胰腺组织可通过多种方式获取:
(1)超声内镜引导下细针穿刺抽吸术(endoscopic ultrasound-guided fine-needle aspiration , EUS-FNA)和超声内镜引导下细针穿刺活检术(endoscopic ultrasound-guided fine-needle biopsy , EUS-FNB) 是目前发展成熟、应用广泛的诊断技术 , 在胰腺结核诊断中发挥了重要作用 , 有较好的安全性和可操作性 , 创伤小、并发症少 , 可反复多部位进行 , 病理学诊断率达70%以上[15] 。 EUS-FNA/FNB近年来在穿刺针的类型、大小和采样技术等方面不断发展 , 如具有尖端几何形状的EUS针头 , 特别是Fork-tip和Franseen针头 , 能够获取保留组织结构的较大组织样本 , 减少针刺次数 , 可进一步提高诊断率[16] 。
(2)CT或超声引导下经皮胰腺细针穿刺活检对较小病灶的组织获取不如EUS-FNA/FNB精确 。 超声无辐射 , 其引导下可实时监测穿刺针进针角度、方向和深度 , 避开重要脏器和血管 , 但穿刺路径易受肠气和骨骼的影响;CT能够精确显示病灶的位置和形态 , 增加取材准确性 , 但具有一定辐射性 , 对于脏器和血管不能实时避让 , 穿刺并发症更多[17] 。
(3)外科手术探查亦可获取病变组织 , 当其他技术均无法获得能够用于诊断的胰腺组织且高度怀疑恶性病变时 , 需考虑手术探查 。 病例报道胰腺结核组织病理可见干酪样坏死、肉芽肿、抗酸染色阳性、结核杆菌基因检测阳性 , 超过50%的患者有肉芽肿[18-19] , 但并不具有诊断特异性;抗酸染色阳性更具有诊断意义 , 但报道的病例较少[10];相对于抗酸染色 , 采用聚合酶链式反应技术检测结核分枝杆菌阳性率更高 , 可达43%~80%[6,19] , 同样具有诊断意义 。
在患者治疗过程中 , 胰腺结核治疗方法与肺结核相同 。 研究显示标准抗结核6-12个月可获得较满意的治疗效果[6] , 可根据患者治疗效果延长治疗时间 , 在临床实践中常大于1年[11,19] , 本例患者随诊时胰头病变尚未明显缩小 , 可在长程抗结核治疗后进一步评估 。 有研究表明 , 部分患者会出现抗结核药物的不良反应 , 总体发生率约17.6% , 以肝损害最为常见[20] 。 另外 , 耐药结核的出现也是更换治疗方案的主要原因之一 。 耐药结核包括耐单药结核、多耐药结核、耐多药结核、广泛耐药结核和利福平耐药结核 , 临床治疗中需根据患者药物敏感性试验结果及本地区耐药检测资料 , 作为方案制定和药物选择的依据[21] 。
7 专家点评
北京协和医院消化内科郭涛教授胰腺结核属罕见病 , 临床症状无特异性 。 其诊断往往借助于影像学提示 , 但部分病例影像学上与胰腺恶性肿瘤难以鉴别 , 确诊需组织病理学证据 。 本例患者以胰腺占位为主要表现 , 同时出现十二指肠、胰周淋巴结和腹腔血管受累 , 继发腹水、消化道出血和黄疸 , 病情复杂、进展迅速 , 由于难以获得胰腺组织学或细胞学标本 , 因此给临床诊断带来较大困难 。 对于此类罕见疾病 , 合并多种并发症 , 且病理活检存在风险的情况下 , 需多学科全面评估 , 共同制定诊疗计划 。 本例患者组织学证据尚不能完全肯定结核诊断 , 即使经验性抗结核过程中仍需要密切随诊 , 警惕恶性肿瘤的可能 。 患者在抗结核治疗过程中也并非一帆风顺 , 出现了多种药物副反应:肝功能损害(肝内胆汁淤积)、尿酸升高及PLT降低 。 在逐步明确了导致多种副作用的药物后 , 及时调整对抗结核治疗药物方案 , 并重新启动了抗结核治疗 , 复查病理结果说明治疗有效 。 总之 , 该患者胰腺结核的诊断和治疗均存在一定的难度 , 且相关并发症较多 , 多学科协作进行全面评估诊疗对临床医生具有重要的指导和借鉴作用 。
参考文献
[1] Sharma SK, Mohan A. Extrapulmonary tuberculosis [J]. Indian J Med Res, 2004, 120: 316-353.
[2] Rathi P, Gambhire P. Abdominal tuberculosis [J]. J Assoc Physicians India, 2016, 64: 38-47.
[3] Sharma V, Rana SS, Kumar A, et al. Pancreatic tuberculosis [J]. J Gastroenterol Hepatol, 2016, 31: 310-318.
[4] Eyal AS, Karusseit VO. Tuberculosis of the pancreas mimicking carcinoma [J]. Int J Infect Dis, 2008, 12: 108-110.
[5] Felekouras E, Karavokyros IG, Griniatsos J, et al. Pancreatic tuberculosis: a medical disease posing surgical dilemmas [J]. Int Surg, 2006, 91: 168-173.
[6] Kim JB, Lee SS, Kim SH, et al. Peripancreatic tuberculous lymphadenopathy masquerading as pancreatic malignancy: a single-center experience [J]. J Gastroenterol Hepatol, 2014, 29: 409-416.
[7] Baraboutis I, Skoutelis A. Isolated tuberculosis of the pancreas [J]. JOP, 2004, 5: 155-158.
[8] 严雪敏, 孙昊, 杨爱明. 胰腺结核的临床特点及诊断要点 [J]. 协和医学杂志, 2015: 119-123.
[9] Nagar AM, Raut AA, Morani AC, et al. Pancreatic tuberculosis: a clinical and imaging review of 32 cases [J]. J Comput Assist Tomogr, 2009, 33: 136-141.
[10] Chaudhary A, Negi SS, Sachdev AK, et al. Pancreatic tuberculosis: still a histopathological diagnosis [J]. Dig Surg, 2002, 19: 389-392.
[11] Rana SS, Bhasin DK, Srinivasan R, et al. Distinctive endoscopic ultrasound features of isolated pancreatic tuberculosis and requirements for biliary stenting [J]. Clin Gastroenterol Hepatol, 2012, 10: 323-325.
[12] Sharma V, Rana SS, Bhasin DK. Endoscopic ultrasound guided fine needle aspiration for diagnosis of pancreatic tuberculosis [J]. JOP, 2013, 14: 521.
[13] De Backer AI, Mortele KJ, Bomans P, et al. Tuberculosis of the pancreas: MRI features [J]. AJR Am J Roentgenol, 2005, 184: 50-54.
[14] Santhosh S, Mittal BR, Bhasin D, et al. Role of (18)F-fluorodeoxyglucose positron emission tomography/computed tomography in the characterization of pancreatic masses: experience from tropics [J]. J Gastroenterol Hepatol, 2013, 28: 255-261.
[15] Song TJ, Lee SS, Park do H, et al. Yield of EUS-guided FNA on the diagnosis of pancreatic/peripancreatic tuberculosis [J]. Gastrointest Endosc, 2009, 69: 484-491.
[16] Mitselos IV, Karoumpalis I, Theopistos VI, et al. Endoscopic ultrasonography in pancreatic diseases: advances in tissue acquisition. Endosc Int Open, 2019, 7: e922-e930.
[17] Kalogeraki A, Papadakis GZ, Tamiolakis D, et al. EUS-fine-needle aspiration biopsy (FNAB) in the diagnosis of pancreatic adenocarcinoma: a review [J]. Rom J Intern Med, 2016, 54: 24-30.
[18] Puri R, Thandassery RB, Eloubeidi MA, et al. Diagnosis of isolated pancreatic tuberculosis: the role of EUS-guided FNA cytology [J]. Gastrointest Endosc, 2012, 75: 900-904.
[19] Rao RN, Pandey R, Rana MK, et al. Pancreatic and peripancreatic tuberculosis presenting as hypoechoic mass and malignancy diagnosed by ultrasound-guided fine-needle aspiration cytology [J]. J Cytol, 2013, 30: 130-135.
[20] Farazi A, Sofian M, Jabbariasl M, et al. Adverse reactions to antituberculosis drugs in Iranian tuberculosis patients [J]. Tuberc Res Treat, 2014, 2014: 1-6.
[21] 侍效春, 刘晓清. 耐多药结核病的诊断、治疗和防治策略 [J]. 协和医学杂志, 2011, 2: 305-309.
作者简介:

文章图片
陆佳
北京协和医院消化内科博士研究生 , 博士生导师:方秀才教授、杨爱明教授 。

文章图片
郭涛
北京协和医院消化内科 , 副主任医师 , 副教授 , 1996年毕业于湖南医科大学(原湘雅医学院) , 获临床医学专业学士学位 。 2004年毕业于中国协和医科大学(现北京协和医学院)消化内科专业 , 获博士学位 , 在北京协和医院消化内科工作至今 。
推荐阅读
- 这早餐我从3岁开始吃,三十多年了,从没吃腻过,晶莹剔透很好吃
- 天冷了,怎能不吃此菜?十分钟就上桌,香辣可口还美味,贼香
- 炖猪肉时,牢记“3不放”,肉烂味鲜无腥味,香味十足!
- 南瓜不要煮粥了, 教你做面皮, 比凉皮还简单, 筋道十足又好吃
- 香味十足的几道家常菜,美味营养,解馋下饭,大人孩子都爱吃
- 几道香味十足的家常菜,色香味俱全,简单美味,让家人吃的过瘾
- 一家三口早餐,用了30分钟,营养十几种,网友:比我家午餐都丰盛
- 几道超级美味的下饭菜,做法简单还营养十足,上桌大家都夸你!
- 几道简单好吃的家常美食,好吃又好看,鲜香十足,很受大家的欢迎
- 最爱这懒人早餐,又香又脆,连吃8个不够,十几分钟做全家人早餐





![[央广网]商务部:“直播带货”必须合法合规](http://p2.cri.cn/M00/8E/65/CqgNOl3OWDSAWaVgAAAAAAAAAAA576.1024x586.jpg)
![[一人穷游中国]朋友圈说说五四寄语,最新5.4青年节短信祝福语大全](https://imgcdn.toutiaoyule.com/20200505/20200505163733382066a_t.jpeg)








