Sci Adv丨深度学习超高分辨率成像发现溶酶体对内质网调控( 二 )
由于内质网和溶酶体都可以直接结合马达蛋白运动 , 而这便引申出了重要问题:在内质网和溶酶体的协同作用中 , 谁是动力基础?这一协同作用仅仅存在于内质网局部还是对其整体的结构特征和分布都有作用?更深入的是 , 这一协同作用的生理学意义是什么?带着这一系列问题 , Kaminski研究组首先进行了基于超高分辨率成像的统计分析 , 发现溶酶体的协同作用贡献了73%的管状结构延伸长度(对应31%的延伸次数 , 与之前的研究一致) 。 在没有溶酶体参与时 , 多数管状结构的伸长经常“后继乏力” , 在还未结合到其他内质网前就收缩了回去 。
 文章插图
文章插图
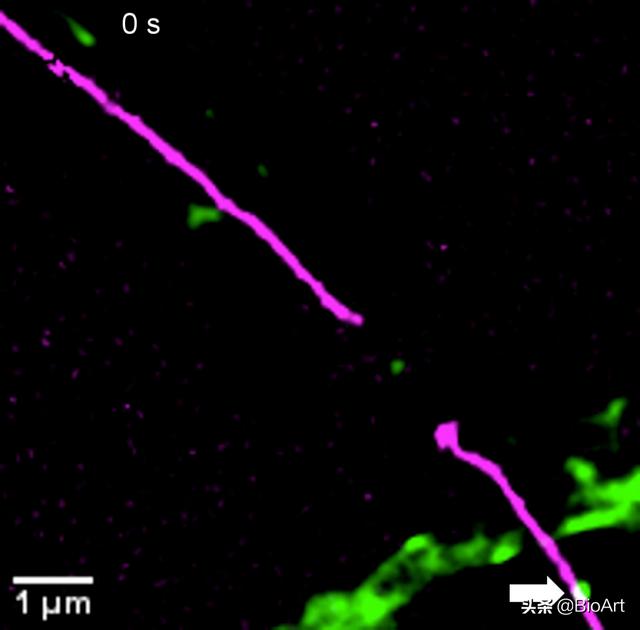
图1. 左图:内质网(紫红色)和溶酶体(绿色)的超高分辨率成像 。 右图:内质网在45秒内的动态叠加图(颜色标记成像时间点) , 黑色部分为不同颜色重叠 , 即稳定不动的内质网结构 。
在进一步的机理研究中 , 为了减弱内质网和溶酶体的锚定强度 , 作者过表达变异蛋白VAPA(KD/MD), 并观察到随着两者的分离 , 溶酶体有一个显著的加速运动 , 而内质网立刻收缩了回去 , 初步证明了溶酶体为协同运动的动力源 。 为了更准确全面地解析其动力基础 , 研究利用细胞器光遗传技术 , 快速诱发全细胞的溶酶体进行顺行运动(anterograde motion), 与此同时 , 观察到内质网管状结构随之快速地铺展到细胞边缘 , 多通道成像观察到新的管状网络完全由溶酶体的定向运动拉伸而形成 。 在4分钟的调控过程中 , 内质网网络如瀑布一般随溶酶体飞喷而出 , 令人想起“飞流直下三千尺 , 疑是银河落九天” 。 由此 , 研究证实了溶酶体运动对内质网动态结构和其胞内时空分布的因果性调控作用 。
图2. 在光遗传诱导的溶酶体(红色)顺行运动(anterograde)中 , 内质网(白色)被溶酶体(红色)拉伸而向细胞外围迅速扩展 。
溶酶体不仅是胞内主要的回收站(recycling) , 而且也是最重要的信号感受器之一 。 其时空分布既受到细胞营养状态的精确调控 , 同时也诱发信号通路对胞内环境的变化做回应 , 维持细胞稳态 。 这一功能和内质网有本质上的关联 。 在解析了两者间的协同作用对内质网形态调控的因果关系后 , 作者更进一步探究其背后的生理学意义 。 研究在细胞内尝试了四种分别能调控溶酶体时空分布的营养状态 , 发现随着溶酶体的分布变化 , 内质网管状结构也随之延伸或收缩 , 进而改变管状和片状结构的分布和比例 。 因此 , 这一溶酶体引导的内质网结构变化和时空分布具有显著的生理学基础 。 更进一步 , 作者将结果扩展到神经元 , 发现在生长的轴突上 , 减弱溶酶体对内质网的锚定和拉伸作用 , 影响轴突生长 , 使其变短变少 。 而超分辨成像显示溶酶体结合管状内质网后进行拉伸运动 , 将断损的内质网快速融合起来 , 保持轴突内质网的结构连续性; 而在内质网和溶酶体锚定作用减弱的神经元中 , 轴突内质网出现了大量断损片段 。 而这验证了溶酶体对内质网调控作用在非极化和极化细胞中都普遍存在 , 尤其是对神经轴突的生成有重要作用 。
这项研究从既有的观察中出发 , 深入解析了溶酶体对内质网快速形变和分布变化的全面而精确的调控作用 , 发现了两者协同运动的动力学基础和生理学意义 。 而在神经发育方面的延伸工作 , 也为接下来多细胞器相互作用在神经生长和退行性病中的作用提供了新的方向和基础 。
 文章插图
文章插图
图3.神经元轴突内溶酶体(绿色)拉伸内质网(紫红色)向前运动 , 从而将两段断开的内质网连接起来 。
展望和畅想
超高分辨率动态成像在近几年越来越普遍地应用到生物学研究中 。 但其中一大难点是如何从图像中获得高质量 , 可靠的分析结果 。 这首先需要大规模成像 , 获得海量的原始图像 , 更需要一系列精准的模式识别工具 , 执行高通量 , 快速 , 无偏倚 , 全自动化的图像识别和分析统计 , 将图像输入转化为具有统计学意义的数字输出 。 这需要细胞生物学 , 超分辨成像和深度学习三者的无缝结合 , 并可能产生一个新的领域——智能成像 。 此论文作为这一结合领域早期的探索工作 , 研究了三者融合的可能性和难点 , 也展示了三者融合的巨大前景 。 在成像的时间尺度上 , 无标记成像在近两年有突破性进展 , 北京大学陈良怡组和施可斌组合作揭示细胞器相互作用的动态全景图 , 使长期无损成像变成了可能【3】(详见BioArt报道:眼见为实|陈良怡/施可彬合作实现对细胞内细胞器相互作用过程的高速三维全景成像 , 揭示细胞器互作全景图和新细胞器) 。 因此我们可以预期 , 无标记成像和超分辨的结合 , 再利用深度学习进行海量图像分析 , 识别出内质网 , 细胞核 , 高尔基体 , 溶酶体等一些列细胞结构 , 并自动化提取其形变 , 运动和分布的规律 , 将在前所未有的时间尺度上解析胞内动态过程 , 研究多种结构的相互作用提供最有力的支撑 。 而在成像的空间尺度上 , 最有代表性的前沿工作便是清华大学戴琼海团队在2019年研制出RUSH(实时超大视场高分辨率显微镜) , 在清醒小鼠的全脑皮层进行宽场动态成像 , 记录脑动态网络结构 , 神经血管耦合等生理病理过程【4】 。 可以预期 , 当深度学习与RUSH所代表的的超大视场成像相结合 , 进行全自动化分析与模式识别后 , 将有可能利用深度神经网络提取出调控行为的全脑神经信号的动态特征 , 如果再与光/化学遗传学相结合就可以解析环路与行为的因果机制 , 另一方面 , 如与超高分辨率成像结合 , 便可定点观察局部神经元的胞内结构变化 , 解析神经环路重要节点的细胞生物学基础 。
推荐阅读
- 创维小湃盒子P3 Pro深度评测
- 把时间花在更有价值的地方,关注这几个有深度的订阅号
- 新基建下,系统集成商数字化建设及渠道管理深度解析
- 新王登基!小米11深度评测:年度真香旗舰预订?
- 打破开发壁垒,2020深度学习开发者峰会百度飞桨认证PPDE分享开源收获
- 深度解读埃森哲《企业智能工作白皮书》,智能工作模式发展有四阶段
- 内容深度打通 喜马拉雅X Redmi小爱音箱Play联名音箱上线
- 「深度」12年了,苹果和特斯拉的爱恨情仇仍在继续
- 为将Windows 10引入Apple Silicon Mac 微软与Parallels展开了深度合作
- 适用于机器学习、数据科学和深度学习,不同价位最好的笔记本电脑















