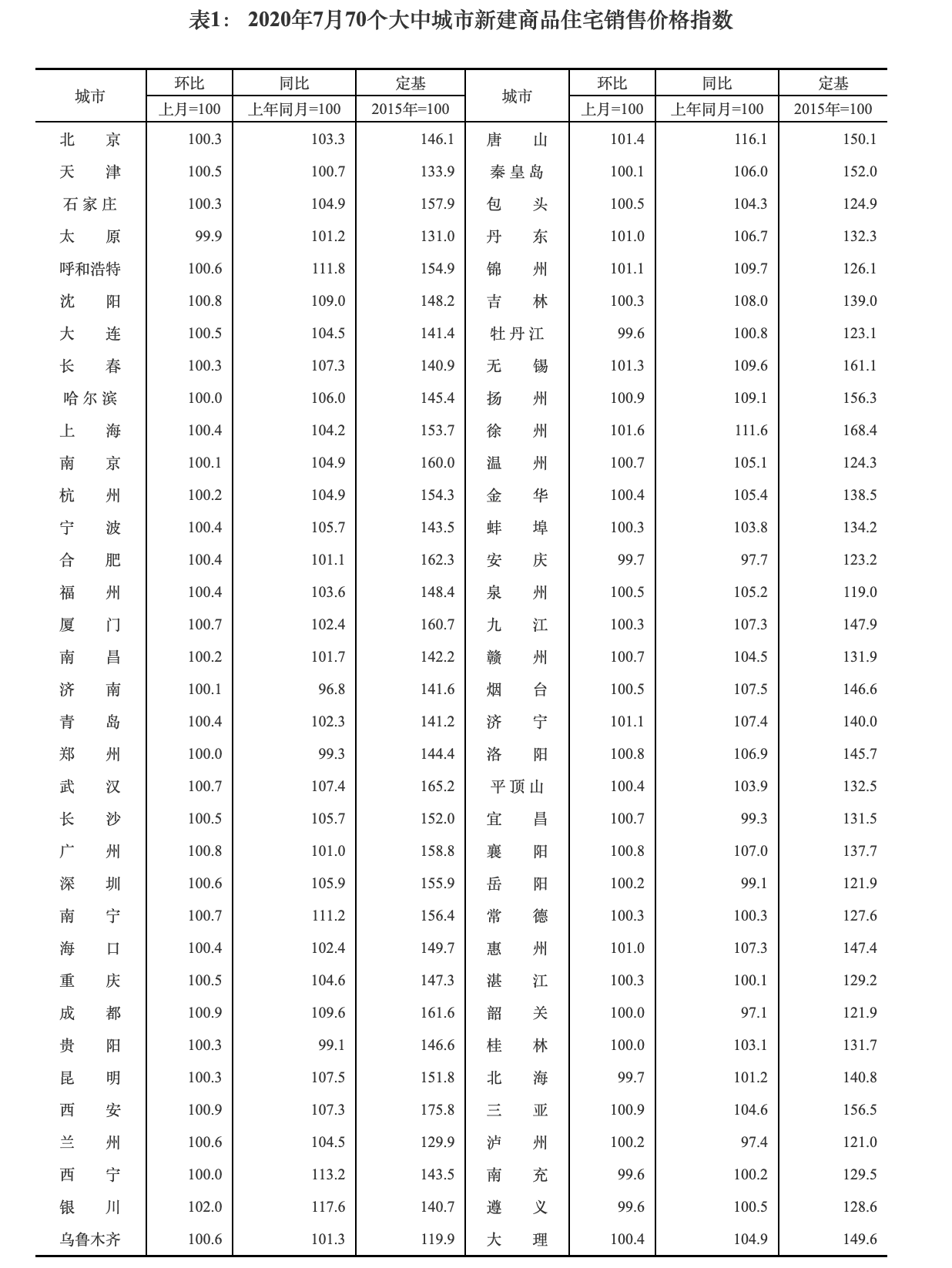
иҚҜжҳҺеә·еҫ·зҪ•и§Ғз—…дё“ж Ҹ дёҖе‘ЁзҪ•й—»иҚҜдәӢ( дәҢ )
>>зӮ№жӯӨи®ҝй—®ж–Үз« е…Ёж–Ү
06еҮҸе°‘дёҚиүҜеҸҚеә”ж–°зӯ–з•Ҙ пјҢ еӨ§з–ұжҖ§зұ»еӨ©з–ұз–®ж–°з–—жі•иҫҫ2жңҹиҜ•йӘҢз»ҲзӮ№
5жңҲ1ж—Ҙ пјҢ Akari Therapeuticsе®Јеёғ пјҢ е…¶дҪңз”ЁдәҺзҷҪдёүзғҜе’ҢиЎҘдҪ“йҖ”еҫ„зҡ„ nomacopan еңЁдёҖйЎ№е®Ңе…ЁжӢӣеӢҹзҡ„еӨ§з–ұжҖ§зұ»еӨ©з–ұз–®пјҲBPпјү2жңҹиҜ•йӘҢдёӯиҫҫеҲ°дәҶдё»иҰҒе’Ңж¬ЎиҰҒз»ҲзӮ№ гҖӮ Nomacopan жҳҜдёҖз§ҚзӢ¬зү№зҡ„ C5 е’Ң LTB4 еҸҢйҮҚжҠ‘еҲ¶еүӮ пјҢ 2жңҹз ”з©¶ж•°жҚ®жҳҫзӨәдәҶиҜҘиҚҜзҡ„еҝ«йҖҹдёҙеәҠеә”зӯ”е’ҢиүҜеҘҪзҡ„е®үе…ЁжҖ§зү№еҫҒ пјҢ еҜ№дәҺж”№еҸҳдёҙеәҠжІ»з–—зӯ–з•Ҙ пјҢ йҷҚдҪҺжІ»з–—еүҜдҪңз”Ёе…·жңүз§ҜжһҒж„Ҹд№ү гҖӮ Akariе…¬еҸёжҺҘдёӢжқҘе°Ҷе°ұ3жңҹе…ій”®жҖ§з ”究и®ҫи®ЎдёҺFDAе’ҢEMAиҝӣиЎҢжІҹйҖҡ гҖӮ
>>зӮ№жӯӨи®ҝй—®ж–Үз« е…Ёж–Ү
07зі–еҹәеҢ–жҠ—CD20еҚ•жҠ—жІ»з–—еӨҚеҸ‘еһӢеӨҡеҸ‘жҖ§зЎ¬еҢ–зҡ„2жңҹз ”з©¶ж•°жҚ®е…¬еёғ пјҢ зј“и§ЈзҺҮ100%
5жңҲ1ж—Ҙ пјҢ TG Therapeuticsе…¬еҸёе®Јеёғ пјҢ еңЁеӨҚеҸ‘еһӢеӨҡеҸ‘жҖ§зЎ¬еҢ–пјҲRMSпјүжӮЈиҖ…дёӯиҜ„дј°е…¶з ”з©¶еһӢзі–еҹәеҢ–жҠ—CD20еҚ•е…ӢйҡҶжҠ—дҪ“ublituximabзҡ„еӨҡдёӯеҝғ2жңҹдёҙеәҠиҜ•йӘҢзҡ„з»“жһңе·ІеҸ‘иЎЁдәҺгҖҠеӨҡеҸ‘жҖ§зЎ¬еҢ–жқӮеҝ—гҖӢпјҲMultiple Sclerosis Journalпјү гҖӮ ж•°жҚ®иЎЁжҳҺ пјҢ 48е‘Ёзҡ„йҡҸи®ҝжңҹеҶ… пјҢ дёүж¬Ўз»ҷиҚҜеҗҺзҡ„зј“и§ЈзҺҮпјҲresponder rateпјүдёә100% пјҢ 第48е‘Ёзҡ„е№ҙеӨҚеҸ‘зҺҮпјҲARRпјүдёә0.07 пјҢ е…ЁйғЁ48дҫӢжӮЈиҖ…зҡ„и„‘йғЁ MRI жү«жҸҸдёӯеқҮжңӘеҮәзҺ°ж–°еҸ‘жҲ–жҢҒз»ӯжҖ§зҡ„й’Ҷеўһејәз—…еҸҳ пјҢ дё”ublituximabзҡ„дёҖиҲ¬иҖҗеҸ—иүҜеҘҪ гҖӮ TGе…¬еҸёиЎЁзӨәе°Ҷ继з»ӯжҺЁиҝӣеҗҺз»ӯзҡ„дёӨйЎ№3жңҹз ”з©¶ гҖӮ
>>зӮ№жӯӨи®ҝй—®ж–Үз« е…Ёж–Ү
жң¬ж–ҮжҸ’еӣҫ
еӣҫзүҮжқҘжәҗпјҡPixabay
08BMSеҲӣж–°з–—жі•зҡ„ж–°иҚҜз”іиҜ·иҺ·FDAдјҳе…Ҳе®ЎиҜ„иө„ж ј пјҢ з”ЁдәҺжҖҘжҖ§й«“зі»зҷҪиЎҖз—…
5жңҲ2ж—Ҙ пјҢ зҷҫж—¶зҫҺж–Ҫиҙөе®қпјҲBristol Myers Squibb, BMSпјүе®Јеёғ пјҢ FDAе·ІжҺҘеҸ—е…¶еңЁз ”еҸЈжңҚдҪҺз”ІеҹәеҢ–иҚҜзү©CC-486зҡ„ж–°иҚҜз”іиҜ·пјҲNDAпјү пјҢ еҗҢж—¶жҺҲдәҲиҝҷдёҖз”іиҜ·дјҳе…Ҳе®ЎиҜ„иө„ж ј пјҢ йў„и®ЎеңЁд»Ҡе№ҙ9жңҲ3ж—Ҙд№ӢеүҚеҒҡеҮәеӣһеӨҚ гҖӮ CC-486з”іиҜ·зҡ„йҖӮеә”з—Үдёә пјҢ дҪңдёәз»ҙжҢҒз–—жі•жІ»з–—жҖҘжҖ§й«“зі»зҷҪиЎҖз—…пјҲAMLпјүжҲҗдәәжӮЈиҖ… гҖӮ жӯӨж¬Ўз”іиҜ·жҳҜеҹәдәҺдёҖйЎ№йҡҸжңәеҸҢзӣІе®үж…°еүӮеҜ№з…§зҡ„3жңҹдёҙеәҠз ”з©¶з»“жһң пјҢ ж•°жҚ®жҳҫзӨә пјҢ CC-486жІ»з–—з»„жӮЈиҖ…дёӯдҪҚжҖ»з”ҹеӯҳжңҹдёә24.7дёӘжңҲ пјҢ иҫғд№Ӣе®үж…°еүӮз»„жңүз»ҹи®ЎеӯҰж„Ҹд№үзҡ„жҳҫи‘—жҸҗй«ҳпјҲp=0.0009 пјҢ HR 0.69 [95% CI: 0.55, 0.86]пјү гҖӮ
>>зӮ№жӯӨи®ҝй—®ж–Үз« е…Ёж–Ү
09дәҡзӣӣеҢ»иҚҜ第дёүд»ЈBCR-ABLжҠ‘еҲ¶еүӮиҺ·FDAеӯӨе„ҝиҚҜиө„ж ј
5жңҲ4ж—Ҙ пјҢ дәҡзӣӣеҢ»иҚҜе®Јеёғ пјҢ FDAе·ІжҺҲдәҲе…¶еҖҷйҖүиҚҜзү©HQP1351жІ»з–—ж…ўжҖ§йӘЁй«“жҖ§зҷҪиЎҖз—…пјҲCMLпјүзҡ„еӯӨе„ҝиҚҜиө„ж ј пјҢ жӯӨж¬Ўиө„ж ји®Өе®ҡжҳҜдәҡзӣӣеҢ»иҚҜиҺ·еҫ—зҡ„йҰ–дёӘеӯӨе„ҝиҚҜиө„ж ји®Өе®ҡ гҖӮ HQP1351жҳҜдёҖз§Қж–°еһӢеҸЈжңҚејәж•Ҳзҡ„第дёүд»ЈBCR-ABLжҠ‘еҲ¶еүӮ пјҢ д№ҹжҳҜдёӯеӣҪејҖеҸ‘зҡ„йҰ–ж¬ҫй’ҲеҜ№иҖҗиҚҜCMLзҡ„第дёүд»ЈBCR-ABLжҠ‘еҲ¶еүӮ гҖӮ иҜҘеҖҷйҖүиҚҜзү©зӣ®еүҚжӯЈеңЁдёӯеӣҪејҖеұ•зҡ„е…ій”®жҖ§2жңҹз ”з©¶дёӯиҝӣиЎҢиҜ„д»· пјҢ и®ЎеҲ’дәҺд»Ҡе№ҙеңЁдёӯеӣҪйҖ’дәӨж–°иҚҜдёҠеёӮз”іиҜ· гҖӮ
>>зӮ№жӯӨи®ҝй—®ж–Үз« е…Ёж–Ү
10еӨ©дҪҝз»јеҗҲеҫҒеҸҚд№үеҜЎж ёиӢ·й…ёз–—жі•иҺ·FDAеҝ«йҖҹйҖҡйҒ“иө„ж ји®Өе®ҡ
5жңҲ4ж—Ҙ пјҢ GeneTx Biotherapeuticsе’ҢUltragenyxе®Јеёғ пјҢ FDAе·ІжҺҲдәҲGTX-102жІ»з–—еӨ©дҪҝз»јеҗҲеҫҒпјҲASпјүзҡ„еҝ«йҖҹйҖҡйҒ“иө„ж ј гҖӮ GTX-102жҳҜдёҖз§Қз ”з©¶жҖ§еҸҚд№үеҜЎж ёиӢ·й…ё пјҢ зӣ®еүҚжӯЈеңЁдёҖйЎ№жІ»з–—ASзҡ„1/2жңҹз ”з©¶дёӯиҝӣиЎҢиҜ„дј° гҖӮ ASдё»иҰҒиЎЁзҺ°дёәзІҫзҘһеҸ‘иӮІиҝҹж»һ пјҢ иҜӯиЁҖгҖҒиҝҗеҠЁжҲ–е№іиЎЎеҸ‘иӮІйҡңзўҚгҖҒеҝ«д№җиЎҢдёәгҖҒзҷ«з—«зӯү пјҢ еёёиў«иҜҜиҜҠдёәиҮӘй—ӯз—ҮжҲ–и„‘зҳ« пјҢ зӣ®еүҚе°ҡж— иҺ·жү№з–—жі• гҖӮ
>>зӮ№жӯӨи®ҝй—®ж–Үз« е…Ёж–Ү
жң¬ж–ҮжҸ’еӣҫ
еӣҫзүҮжқҘжәҗпјҡPixabay
11SotaterceptиҺ·EMAжІ»з–—иӮәеҠЁи„үй«ҳеҺӢзҡ„дјҳе…ҲиҚҜзү©и®Өе®ҡ
5жңҲ5ж—Ҙ пјҢ EMAе®ЈеёғжҺҲдәҲAcceleronе…¬еҸёзҡ„sotaterceptз”ЁдәҺжІ»з–—иӮәеҠЁи„үй«ҳеҺӢпјҲPAHпјүзҡ„дјҳе…ҲиҚҜзү©пјҲPRIMEпјүи®Өе®ҡ гҖӮ иҝҷйЎ№иө„ж ји®Өе®ҡеңЁFDAжҺҲдәҲsotaterceptвҖңзӘҒз ҙжҖ§з–—жі•вҖқи®Өе®ҡд»…д»…еҮ е‘ЁеҗҺ гҖӮ иҖҢеңЁ2019е№ҙ пјҢ FDAжӣҫжҺҲдәҲsotaterceptз”ЁдәҺPHAзҡ„еӯӨе„ҝиҚҜиө„ж ј гҖӮ SotaterceptжҳҜдёҖз§ҚиҜ•йӘҢжҖ§з–—жі• пјҢ е°ҡжңӘеңЁд»»дҪ•еӣҪ家иҺ·жү№ пјҢ зӣ®еүҚжӯЈеңЁ2жңҹSPECTRAиҜ•йӘҢдёӯиҜ„дј°е…¶еңЁPAHжӮЈиҖ…дёӯзҡ„ж•Ҳжһң гҖӮ
жҺЁиҚҗйҳ…иҜ»
- иүҫеЁғElvaaTBз©ҝиҘҝиЈ…иЎ¬иЎ«жўіиғҢеӨҙеғҸжҖ»иЈҒпјҢдәәеё…еҝғзҫҺз”·жҳҹзҪ•и§ҒпјҢеҗҙдәҰеҮЎйҰ–ж¬Ўе…¬зӣҠзӣҙж’ӯ
- ж—¶е…үTtttimeй“Ҷй’үй…Қз»ҝиүІеҲәзҢ¬еӨҙпјҢдёҺзҺ°еңЁеҸҚе·®еӨӘеӨ§пјҢдјҠдёҮеҚЎвҖңйӣ·дәәвҖқз…§зүҮзҪ•и§Ғжӣқе…ү
- ж—¶е°ҡйӣӘзҫҪжҳҜз©ҝдәҶйҷҲжҷ“зҡ„иЈӨеӯҗпјҹйғҪеҸҜд»ҘеЎһдёӢ6жқЎи…ҝдәҶпјҢйҷҲеҰҚеёҢзҪ•и§Ғз§ҖжҒ©зҲұ
- YuYuж–ҮйҰЁж—¶й«Ұжңӯи®°й»„жҷ“жҳҺзҪ•и§ҒиҗҘдёҡпјҢз©ҝзҒ°иҘҝиЈ…+жё”еӨ«еёҪпјҢдёҖиә«иЈ…жү®жҪ®жөҒеҮҸйҫ„пјҢзңӢдёҚеҮә42пјҢеҺҹеҲӣ
- иҫЈеҰҲж—¶е°ҡиҢғ86еІҒеҪӯзҺүзҪ•и§ҒйңІйқўпјҢз©ҝзҡ„жҷ®йҖҡеҚҙеҫҲдјҳйӣ…пјҒпјҢд»ҺжІЎи§ҒиҝҮиҖҒиҫҲжј”е‘ҳжү®е«©
- дёҫдёӘжўЁеӯҗиҜҙж—¶е°ҡз”ҹиҝҮеЁғеҗҺз«ҹ然дёҖдёӘжҜ”дёҖдёӘзҳҰпјҢеӨӘеҸҜжҖ•пјҢAngelababyе’ҢиөөдёҪйў–зҪ•и§ҒеҗҢжЎҶ
- ж№–еҚ—зңҒиғёз§‘еҢ»йҷўз«ҹжҳҜиҝҷдёӘвҖңзҪ•и§Ғз—…вҖқеј•иө·пјҢ33еІҒеҘіеӯҗз»қз»ҸгҖҒи„ұеҸ‘гҖҒзІҫзҘһејӮеёё
- гҖҢз–ҫз—…гҖҚдҪҝдёҖдәӣдәәиҺ·еҫ—вҖңи¶…зә§иғҪеҠӣвҖқзҡ„5з§ҚзҪ•и§Ғз–ҫз—…
- SevenиҒҠж—¶е°ҡж•…ж„Ҹз©ҝдёүеҲҶиЈӨз§ҖзҫҺи…ҝпјҢзҪ•и§Ғзҡ„й•ҝеҸ‘йҖ еһӢеӨҹжғҠиүіпјҢ马дјҠзҗҚзңҹдјҡзҺ©
- ж№–еҚ—еҢ»иҒҠзҪ•и§ҒпјҒеҘіеӯҗиғҢдёҠй•ҝдәҶ3ж–ӨйҮҚзҡ„вҖңй”…вҖқпјҢеҢ»з”ҹиҠұ2е°Ҹж—¶жүҚеҲҮдёӢжқҘ