药监局连发9大重磅文件,涉化药生物药中药,影响所有医药人

文章图片
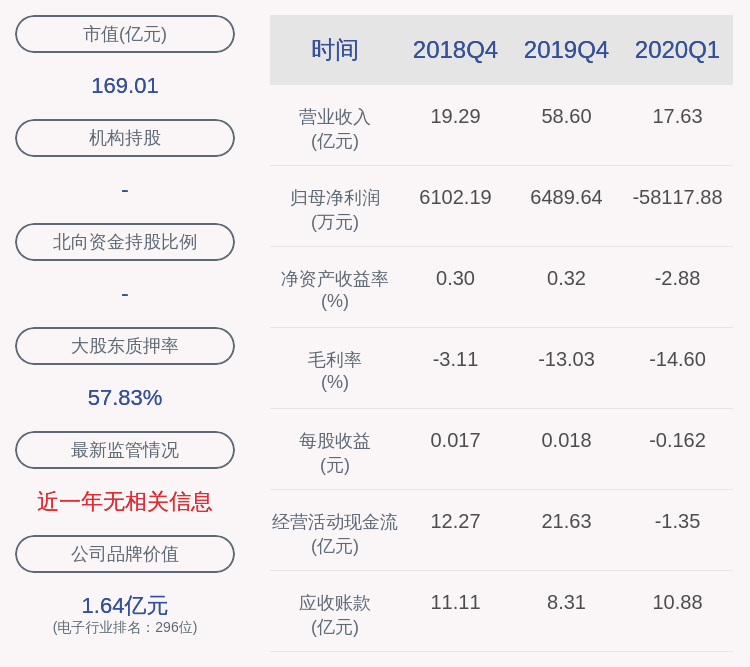
文|AI财经社健识局陈广晶
编|AI财经社健识局严冬雪
本文来源于AI财经社旗下医疗大健康品牌“健识局” , 未经许可 , 严禁转载
全新的药品监管时代来了 。
4月30日 , 国家药监局官网一口气挂出9大征求意见稿 , 全面覆盖了境内、境外 , 化药、生物制品、中药的注册、再注册、上市后临床变更 , 以及疫苗的生产流通等内容 。

文章图片
【药监局连发9大重磅文件,涉化药生物药中药,影响所有医药人】上述文件作为将在7月1日正式实施的《药品注册管理办法》的配套文件 , 进一步明确了化药、生物药、中药创新药的定义 , 行业关注的申报程序、申报材料要求、审查要点等问题进行了细化 。
按照要求 , 5月30日前 , 各界人士可以将反馈意见发送到指定邮箱 , 而最终形成的文件 , 将直接影响2个月后所有品类药品的研发、注册、再注册等工作 。
2015年以来 , 以药品审评审批制度改革、仿制药一致性评价等的启动为开端 , 中国的药品监管已经发生了巨大的变化 。
特别是2019年12月1日 , 新修订的《药品管理法》《疫苗管理法》已经进入执行阶段;药品的注册管理办法、生产管理办法也于3月底完成了时隔13年、18年的首次大规模修订并发布 , 其中临床试验默许制、串联改并联等 , 都将极大促进中国的新药创新 。
此次发布的一系列配套文件则将最终确保上述利好落地 。 结合针对非专利药的带量采购、仿制药一致性评价 , 以及医保目录动态调整等政策 , 在仿制药、过专利期原研药进入急剧洗牌期的同时 , 真正具有临床价值的创新产品将迎来研发和市场的黄金时代 。
虽然在过渡期 , 在具体操作中仍然不免存在这样那样的问题 , 但是不可否认的是 , 中国药品监管已经开始从侧重事前监管向以患者为中心的全流程、全生命周期监管转变 。 以此为契机 , 中国2万亿药品市场将实现重置 。
与国际接轨
创新药标准提升更强调临床价值
可以看到 , 9份征求意见稿中 , 关于化药、生物药和中药的注册分类及申报要求等都给出了更加具体的规定 。
特别值得注意的是 , 其中针对化药、生物药、中药创新药 , 做出了新的定义 , 将中国的创新药提升到了新的高度 , 临床价值成为重要的衡量标准 。
在化药领域 , 新药分为创新药和改良型新药 , 必须是境内外未上市的药品 , 且具有临床价值 。

文章图片
对于生物药 , 分类在原有预防用、治疗用的基础上 , 增加了按生物质平管理的体外诊断试剂 , 同时 , 对改良剂型、改变给药途径、剂量等一秒、生物制品 , 要求必须具有明显临床优势 。

文章图片
对中药的创新药 , 也有对临床价值的强调 。 其中包括中药复方制剂、从单一动植物矿物等中提取得到的提取物及其制剂 , 以及新药材及其制剂 。 按照要求 , 中药的新药研发须更加重视临床评估 , 满足尚未满足的临床需求 。
而改剂型、给药途径、增加适应症的产品也列入了改良型新药范畴 。 这被认为将促进中药产业对老药的进一步开发 。

文章图片
事实上 , 针对药品注册分类的改革早在2016年就已经启动了 。 这也被认为是药品审评审批制度改革推进的关键 , 对鼓励药品研发创新、提高质量有重要的意义 。
新的药品注册配套文件在此前改革的基础上 , 根据新修订的《药品注册管理办法》 , 结合此前改革经验 , 进行了细化明确 , 同时 , 兼顾与药物研发技术指导原则等文件的紧密衔接 , 按照设计 , 未来将在审评审批体系中起到承上启下的作用 。
此外 , 在资料申报过程中 , 要求所有药品上市、临床试验和原料药申请均按照CTD格式申报 。 而CTD格式是ICH(国际人用药品注册技术协调会)人用药物注册申请通用技术文档 。 国家药监局此举也进一步加强中国创新药与国际标准接轨 。
这不仅将进一步加快境外创新药进入中国的速度 , 也有利于中国创新药走出国门 。
规范中药管理
中药注射剂千亿市场洗牌来了
在此次征求意见的《中药注册管理专门规定(征求意见稿)》中 , 对中药注射剂的研制也提出了规范要求 , 包括中药注射剂研制须符合注射剂研究的通用技术要求 , 药物活性成分及作用机理须明确 , 并且要开展充分的非临床安全性研究 。
这也意味着 , 中药注射剂已经告别特殊时期的“优待” , 将按照注射剂标准受到更加严格、规范的管理 。
结合上述征求意见稿中 , 关于如果中药上市五年后其说明书中的禁忌、不良反应、注意事项中任何一项还是“尚不明确” , 将不予再注册的要求 , 相关产品将面临上市后评价的考验 。
中药注射剂作为中国特有的品类 , 在此前相当长一段时间里 , 因为缺乏临床数据支持饱受诟病 。 一项早年由浙江丽水市人民医院医生主导的 , 针对30种中药注射剂说明书的调查显示 , 涉及的产品中 , 只有4种有具体的临床试验描述 。
在此基础上 , 中药注射剂的不良反应事件/报告数量也居高不下 , 还曾发生过“鱼腥草注射液致人死亡”事件、喜炎平、红花注射液被紧急叫停等轰动业界的大事件 。 其中由“热原”引起的过敏反应也被认为是中药注射剂难以摆脱的“原罪” 。
尽管如此 , 中药注射剂的销售额连年走高 , 到2016年 , 只有100多个品种的中药注射剂 , 市场规模已经突破了千亿元大关 。
近年来 , 随着临床控费、加强合理用药等政策的推行 , 中药注射剂遭到了来自重点监控、医保支付等多方面的限制 , 市场已经出现萎缩 。
而按照2017年中办、国办发布“鼓励药械创新36条”所说 , 针对中药注射剂安全、有效性的再评价也将给中药注射剂最致命的一击 。
虽然注射剂的上市后再评价并没有明确落实 , 但是以新监管模式 , 对所有药品须开展上市后再评价和强调充分的非临床安全性研究为基础 , 这一品类产品的洗牌也将进入实质性阶段 。
可以看到 , 过敏试验、刺激性试验、溶血性试验等中药注射剂常见问题 , 都是非临床安全性试验的重要内容 。
完善退出机制
明确五种情况药品将无法再注册
在药品再注册相关规定征求意见稿中 , 针对境内、境外生产药品提出了5种不予再注册的情况 。

文章图片
具体包括↓
有效期届满未提出再注册申请的;
药品注册证书有效期内持有人不能履行持续考察药品质量、疗效和不良反应责任的;
未在规定时限内完成药品批准证明文件和药品监督管理部门要求的研究工作且无合理理由的;
经上市后评价 , 属于疗效不确切、不良反应大或者因其他原因危害人体健康的;
法律、行政法规规定的其他不予再注册情形 。
也就是说以再注册为契机大批药品将面临淘汰 。
特别是须通过一致性评价的仿制药 , 按照相关要求 , 自首家品种通过一致性评价后 , 其他药品生产企业的相同品种原则上应在3年内完成一致性评价 。 逾期未完成 , 又不属于临床必需 , 市场短缺的品种 , 将面临不予再注册 , 最终退市的命运 。

文章图片
图/视觉中国
自上世纪80年代以来 , 中国医药市场实现了快速发展 。 根据商务部统计数据 , 2017年全国医药市场总规模已经超过2万亿元 。 国家药监局官方数据显示 , 国产药品批文号达到了16万余个 。
然而 , 在繁荣背后 , 由于没有退出机制 , 实际上很多长期不生产的药品批文未注销 , 很多在国外已经被禁止或限制儿童使用的药品 , 仍然在中国市场畅行无阻 。 这既不利于产业发展 , 也增加了用药风险 。
因此用药评价机制和退出机制 , 也一直是行业及监管部门关注的问题之一 。 在此之前 , 结合国外的药物警戒报告以及国内的药物不良反应监测等情况 , 国家药监局近年来也加强了对药品的动态评估调整 , 通过修订说明书等方式 , 对匹多诺德、安乃近等药品使用做出了限制 。
推荐阅读
- 关于逃顶,你须知道这十大诀窍(附超精准逃顶指标)
- “泡芙消极事件”引关注,Curse:大家都不ping人,除非特别恶心
- 中韩季中杯A组巡礼,综合数据T1和FPX更好,大概率会携手小组出线
- 大乔最适合带什么召唤师技能?闪现最无用,佩戴这个有奇效!
- 足坛史上举世公认的五大左后卫,卡洛斯仅第二,榜首毫无争议
- 沪媒:16家俱乐部退出不必大惊小怪,烧钱一时爽恶果降临
- 独家对话宋亚东:一龙与马保国做了坏表率,大众误以为他们是高手
- 加利亚尼:我心中有一大遗憾,那就是2016年没签下泽林斯基
- 法律点赞全国人大常委会工作:铸法律重器
- 蓝盈莹太会穿了,格子大衣搭牛仔裤潮范十足,实力演绎酷帅风格